Inbreukverbod gegeven vanwege voornemen om na expiratie ABC generiek medicijn te verhandelen
09-11-2023 Print this page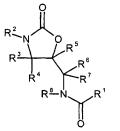
Doseringsregime van antistollingsmiddel rivaroxaban is inventief en daarmee een geldig octrooi; Voor de vakpersoon is het op de prioriteitsdatum vanuit de stand van de techniek (fase I studies) niet voor de handliggend om rivaroxaban (slechts) eenmaaldaags toe te dienen in een fase II studie (aan patiënten); Vordering tot vernietiging van het octrooi wordt afgewezen. Inbreukverbod wordt toegewezen: Sandoz heeft het voornemen om na expiratie van het ABC haar geneesmiddel op de markt te brengen die valt binnen de beschermingsomvang van het octrooi.
OCTROOIRECHT
Bayer was houdster van Europees octrooi EP 1 261 606 B1 voor een “Behandeling van trombo-embolische aandoeningen met rivaroxaban”. Sandoz is van plan, na expiratie van ABC 370 (per 1 april 2024) in Nederland, een generiek geneesmiddel op basis van de stof rivaroxaban in Nederland op de markt te brengen.
Bayer heeft Sandoz verzocht te bevestigen dat zij in Nederland geen rivaroxaban-product op de markt zal brengen of zal opnemen in de G-standaard dat inbreuk maakt op deze (octrooi)rechten.
Sandoz vordert vernietiging van het NL deel van EP961 omdat het niet inventief zou zijn omdat de geclaimde doseringsregime voor de vakpersoon op een voor de hand liggende wijze voortvloeit uit de stand van de techniek.
In deze beoordeling mag niet ontbreken dat ook de praktijk leerde dat (zelfs gespecialiseerde) vaklieden (uit medische-ethische comités) afwijzend hebben gereageerd op het moment dat de onderzoekers van Bayer voorstelden om rivaroxaban eenmaal daags toe te dienen bij klinisch onderzoek. Zo heeft een Spaans medisch-ethisch comité geweigerd om met deze onderzoeksarm mee te doen.
De relevante vakpersoon, uitgaande van het objectieve technische probleem en gebruikmakend van de resultaten van de Kubitza en Harder fase I studies, de veiligheid en effectiviteit van rivaroxaban in patiënten (fase II studie) zou onderzoeken in een twee- of driemaal daagse dosering met een redelijke verwachting van succes. De vakpersoon zou een inventieve stap moeten zetten om te komen tot het in het octrooi geclaimde eenmaal daagse doseringsregime. Dit geldt ongeacht of uitgegaan wordt van Harder (Poster) in combinatie met Kubitza II of vice versa. Dit brengt mee dat het octrooi inventief en dus geldig is. De rechtbank vindt hiervoor steun in de oordelen van de TKvB en de Noorse rechter.
De rechtbank wijst de vordering van Sandoz af.
Het octrooi is geldig. Het voornemen van Sandoz om een generieke versie in Nederland op de markt te brengen na expiratie van het ABC en Sandoz niet heeft bestreden dat haar product onder de beschermingsomvang valt is er sprake van een concrete dreiging die een inbreukverbod rechtvaardigt.
IEPT20231101, Rb Den Haag, Sandoz v Bayer
ECLI:NL:RBDHA:2023:16452